北理工课题组在CRISPR系统元件筛选方面取得重要进展
发布日期:2024-06-03 供稿:生命学院 摄影:生命学院
编辑:肖雯 审核:周连景 阅读次数: 2148
近日,bob手机在线登陆霍毅欣教授团队在CRISPR/Cas9系统功能性sgRNA突变体筛选方面取得重要进展。相关研究成果以“Identification of functional sgRNA mutants lacking canonical secondary structure using high-throughput FACS screening”为题发表在Cell 子刊《Cell Reports》上(https://doi.org/10.1016/j.celrep.2024.114290)。该工作以bob手机在线登陆为第一通讯单位,博士生梁泽宇为第一作者,霍毅欣教授为通讯作者。
CRISPR/Cas9介导的基因编辑已经成为一种强大的基因改造技术,该系统的主要元件为Cas9蛋白与sgRNA。在sgRNA的引导下,Cas9-sgRNA二元复合体可以识别特定的DNA靶点,并在该位点使DNA序列产生双链断裂。在对底盘菌株进行代谢工程改造时,往往需要对多个目标靶点进行基因操作,而在CRISPR系统中共表达多个相同的sgRNA易触发遗传不稳定性导致序列丢失。现有的sgRNA筛选系统通常是基于CRISPRi系统设计的,因此无法保证所筛选得到的sgRNA突变体与Cas9蛋白形成复合体后仍具有核酸酶活性 (图1)。相同sgRNA突变体与Cas9结合后抑制活性与核酸酶活性不一致这一现象有研究提及,但尚未得到系统分析和详细报道。为了评价现有的sgRNA突变体是否可以用于基因改造,我们系统性地设计了鉴定sgRNA突变体与Cas9蛋白结合后DNA结合活性与核酸酶活性的系统,发现相同的sgRNA序列两种活性存在不一致的情况。因此我们需要得到与现有的野生型sgRNA序列差异较大的sgRNA突变体。
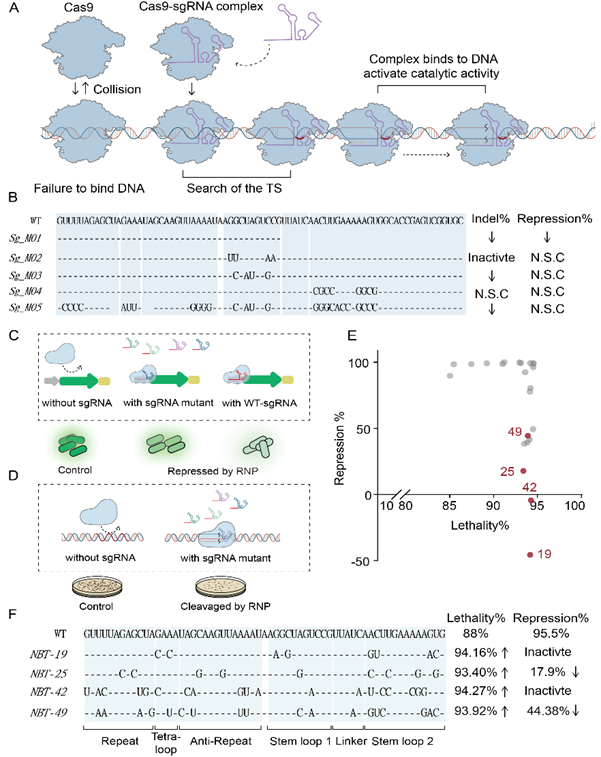
图1 现有sgRNA突变体活性分析
本团队长期从事CRISPR系统机制探究以及高效基因编辑方法学开发,2019年以“CRISPR-Cas9-assisted native end-joining editing offers a simple strategy for efficient genetic engineering in Escherichia coli”为题,在领域顶级期刊《Applied Microbiology and Biotechnology》上发表。该工作报道了一种基于原核体内的微同源末端重组系统的CRISPR/Cas9基因编辑方法,是一种最简单的基因编辑方法。我们利用该研究的DNA修复方法设计了一种基于生长和/或荧光激活细胞分选(FACS)的高通量sgRNA突变体正向筛选系统。我们首先在筛选标签中插入一段可以被识别的DNA靶点序列,并引入一段同源序列。当sgRNA突变体与Cas9蛋白形成二元复合体,并在有活性的sgRNA突变体引导下结合至DNA靶点序列形成三元复合体,激活Cas9蛋白核酸酶活性后,在所设计的DNA靶点将会出现双链断裂,激活原核细胞内的同源修复系统。该同源修复系统利用我们所引入的同源序列进行筛选标签的修复,使得细胞在筛选条件下出现可被筛选的表型,如可在抗性平板上生长或是通过流式细胞仪进行分选 (图2)。
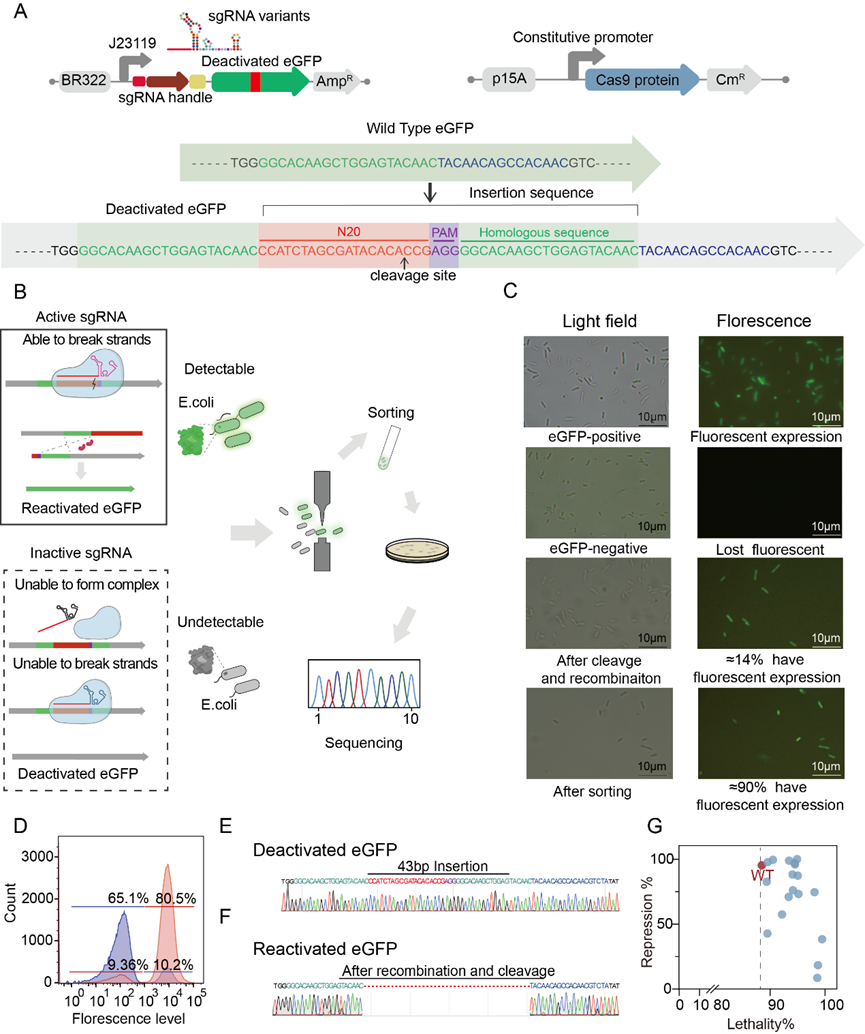
图2 sgRNA突变体筛选体系构建与验证
之后我们根据sgRNA的结构,分区进行突变库构建与筛选,将筛选得到的6个单区有活性的突变序列进行随机组合。利用该筛选系统,我们得到了具有突变率超过50%的sgRNA突变体序列,并且这些sgRNA突变体与Cas9蛋白形成复合体后仍能够在细胞内保持与野生型水平相当的核酸酶活性。通过结构模拟,我们发现这些sgRNA突变体由于具有高的序列突变率而失去了公认的典型二级结构,这表明Cas9蛋白与sgRNA突变体可以相互适应并进行结构校正。进一步,我们将高通量筛选系统与高通量测序技术相结合。通过高通量测序,最终得到了大量sgRNA突变体序列,并且这些突变体序列均与野生型sgRNA序列有巨大差异 (图三)。
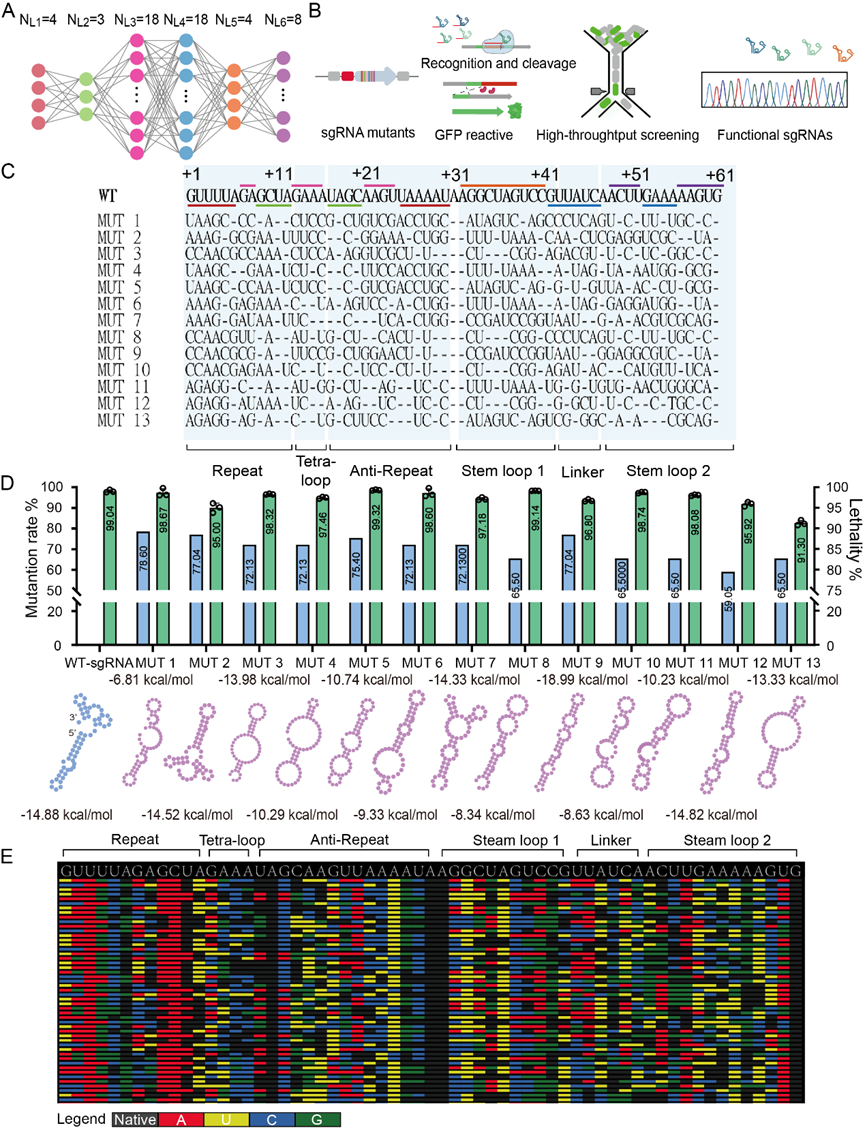
图3 sgRNA突变体筛选结果
我们使用这些sgRNA突变体开发了基于CRISPR/Cas9的多靶点基因编辑工具箱,可以同时实现至多4个位点的基因敲除以及碱基突变。利用该基因编辑工具箱,我们实现了底盘细胞快速工程化改造,得到一系列敲除了不同副途径的异丁醇生产菌株,并实现异丁醇高产菌株的构建成功将化学品异丁醇的摇瓶产量提高到了13.9g/L。为了拓展该系统的应用范围,我们利用该工具箱构建菌株突变库,并与本团队所报道的生物传感器BmoR相结合,筛选得到1,3-PDO高产菌株(图4),并且与野生型相比突变菌株的产量提高了4.5倍。
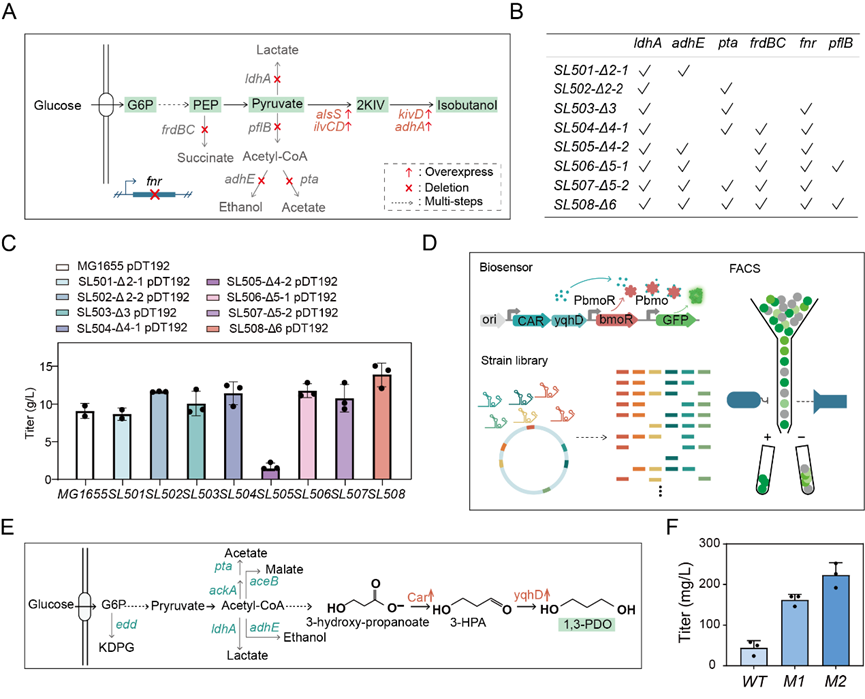
图4 sgRNA突变体在代谢工程中的应用
此项工作以bob手机在线登陆为唯一通讯单位,得到了国家重点研发计划的支持,也感谢bob手机在线登陆生物与医学工程公共实验中心的支持。
分享到:
